化学基礎「化学反応式とその量的関係」のライブ授業(風記事)~教育実習での授業実践から~【理科教育 Advent Calendar 2021】
<注意事項>
- この記事は,私が今年度に実施した教育実習で実際に行った授業を,授業の雰囲気そのままに一部改変・追記して,「理科教育 Advent Calender 2021」に向けて記事にしたものです.
- 私は(科学コミュニケーションは多少経験のある身ですが)理科教育を専門に学んだ身ではありません.理科教育の素人が行った実践として温かい目で見ていただければと思います.
- 普段はアメブロでぼちぼち記事を書いたりしています.また,Twitterが最も更新頻度が高いので,興味を持っていただけた方はTwitterの方をフォローしていただけると幸いです.
--

こんにちは!
それでは授業を始めましょう.今日のテーマは「化学反応式の表す量的関係」です.これまでの授業で,みなさんは化学を量で表すための道具である「物質量」と,化学反応を書き表すための言葉である「化学反応式」を手に入れてきました.
今日の授業では,この2つの道具を駆使して,化学反応を「定量的」に議論していこうと思います.*1
--

まずは簡単に前回の復習をしましょう.前回のテーマは化学反応式でした.化学反応式とはどのようなものかという定義や,化学反応式を書くときのルールについてやりましたね.これらは言葉や文法*2のようなものなので,きちんと押さえておくことが重要です.
その後に,原子説と矛盾しないように化学反応式を組み立てる方法を扱いました*3.未定係数法は授業であまり扱えませんでしたが*4,もし興味がある人は教科書の○○ページを見ておいてください.
そして最後に,化学反応式のうち反応に関わるイオンのみを抜き出したイオン反応式というものも扱いました*5.この後の単元で扱う酸塩基反応や酸化還元反応でたくさん出てくるので,しっかり押さえておきましょう.イオン反応式では,反応前後で電荷が等しいことを確認するのをお忘れなく.
それで今回のテーマは「化学反応を『定量的』に見る」ことです.ん,「定量的」ってなんぞや? と思う人が多いと思うので,まずは「定量的」の意味を辞書で確認しておきましょう.「定量的」とは,簡単にいうと「数字に直して考えること」です.例えば「1 molの鉄」や「18 gの水」などは,数字で考えているので「定量的」なわけです.一方で,「色が赤色に変わった」「沈殿が生じた」といったものは,(数字で表すこともできますが)数字に直して考えていません.このように「数字で表せない性質に着目すること」を「定性的」といいます.この2つはどっちも大切な考え方なので押さえておきましょう*6.今日はこのうち,数字で表す「定量的」の方に焦点を当てて考えていきます.
--

まず,化学を「定量的」に見てきた歴史を簡単に振り返っておきましょう*7.カギとなる化学者はたくさんいますが,その中でも特に「定量的」において重要な人物を挙げるとしたら,ロバート・ボイルとアントワーヌ・ラヴォアジエの2人になります.
まずボイルは,科学としての化学,つまり化学を数字で表して考えることを初めて行った人物です*8.ボイルが発見した法則であるボイルの法則は,圧力という数字と体積という数字とをかけ合わせると,どのような気体でも同じ値になると言っています*9.詳しくは来年以降の化学で扱うので,今覚えようとしなくても大丈夫です*10.
もう1人はみなさん名前は聞いたことがあるのではないかと思います,定量化学の父であるラヴォアジエです.ラヴォアジエが発見した質量保存の法則は,化学反応の前後において物質の総質量は変化しないというものです.もちろん,質量は数字で表すことができますよね.前回の授業に出てきた原子説は,この質量保存の法則をもとにしているんでした.
このように,量を「はかる」こと,つまり化学を数字で捉えることによって,化学は大きく発展して様々なことが分かるようになり,様々なものが作られるようになってきたのです*11.そしてみなさんはいま,化学を数字で捉えるための強力な武器を持っています.そう,物質量です.
--

では,まず物質量について復習しておきましょう.定義はもちろん教科書に載っていますが,ここではIUPAC Gold Bookに載っている物質量の定義を見てみましょう*12.IUPACは"International Union of Pure and Applied Chemistry"の略で,国際純正・応用化学連合となります.要するに,国際的に定められた物質量の定義ということです.ちなみに,物質量は英語で"amount of substance"といいます.*13
IUPACが定める物質量の定義はこのようになっています.ドーン!…はい,1つずつ追っていきましょう.~(中略)*14~ちなみに最後の"specified group of particles"は,みなさんイメージできますかね? 最近「クラスター」という言葉をよく耳にしますが,化学にもクラスターというものがあって,それはここでいう「同じ種類の原子や分子が集まってできたもの」になります.例えばみなさんこれ何か覚えてますか?(おもむろに分子模型を取り出す) …そう,フラーレンですね.これも炭素原子がこの場合は60個集まってできた分子なので,クラスターの一種ということになります*15.みなさんに分子模型を回すので,しっかり愛でてください.
--

では,物質量とは一体何なのか.カギとなるのは色を付けたところになるので,この部分を中心に日本語でざっくりまとめてみると,「粒子ないし粒子の集まりといった基本的な”もの”の○○の測定単位」となります.○○に入るのは,英語では”number”です.
--

そう,「数」なんです.「個数」なんです.物質量はあくまでも「個数」の単位であることが,国際的にもはっきり決められています*16.とはいえ,これで分かったらわざわざ復習しなくてもみなさん完璧なはずです.まだちょっとしっくりこない.ということで,物質量の概念を例えを使って見ていきましょう.
--

私は,物質量は「お金」に例えて理解すると分かりやすいのではないかと考えています*17.
例えばみなさん,パソコンって買ったことありますか? 私がパソコンを買ったときは大体15万円だった記憶があるので,15万円のパソコンを買うことを考えます.日本におけるお金の単位は「円」なので,基準となるお金は「1円玉」になります.「基準は1」というのは科学の基本ですね.
ではみなさん,15万円のパソコンを買うときに1円玉15万枚を出して買いますか? さすがにそんなことしませんよね.もし私が家電量販店の店員だったら,「パソコンください!」と袋いっぱいの1円玉を持ってのっしのっし来られたら困りますね.ちなみに,一度に20枚以上の同種の硬貨を使って支払おうとした場合,お店側は受け取りを拒否してもよいと法律で決まっている*18ので,私だったら間違いなく受け取りを拒否します.
--

では,15万円のパソコンは買えないかといわれるとそんなことありませんし,むしろそれじゃ困りますよね.何を使って払いますか? そうそう,1万円札ですね.ここで,この1万円札はどういうものか考えてみると,1円玉が1万枚あるときと同じ価値をたった1枚のお札で表せるような,「数を減らすことができる新しいユニット」を考えているのです.そしてめでたく,この1万円札を15枚だけ使うことで15万円のパソコンを買うことができるようになるわけです.
--
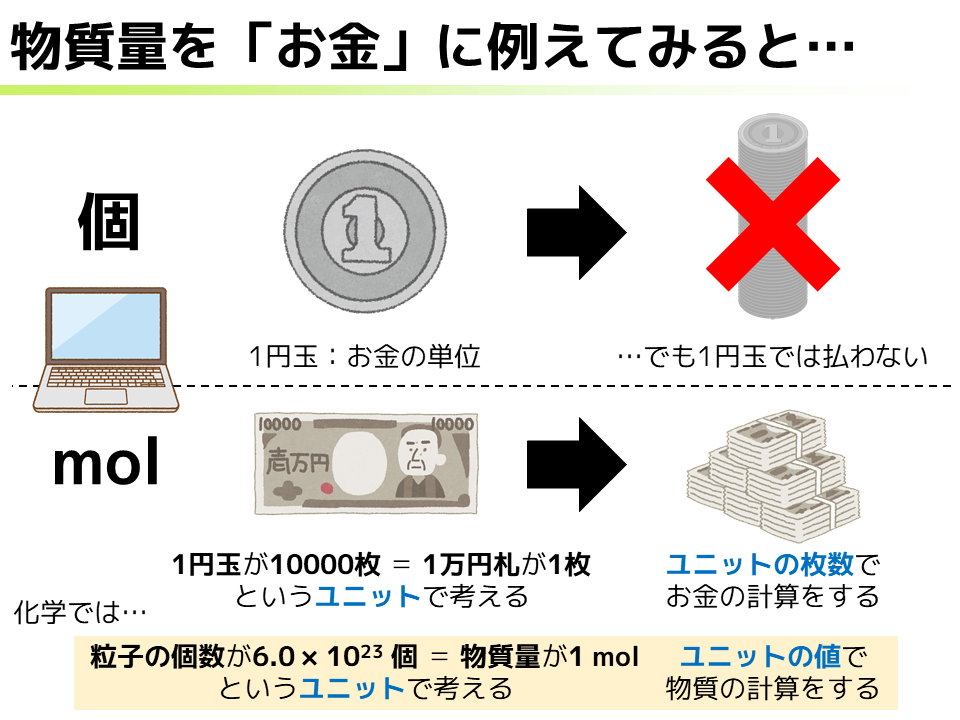
ここで化学の世界に戻ってきましょう.ずばり,今説明したような「玉と札の関係」こそが「個とmolの関係」と同じなのです*19.化学では,めちゃくちゃ小さいサイズの原子がたーくさん集まったもの*20を考える必要が出てきます.もちろん1個1個考えることもできますが,10の23乗個レベルのものすごい数を扱うのは非常に面倒です.そこで,6.0×10^23個の粒子を1 molとする新たなユニットとして物質量を考え,それを使って物質の計算をするようなルールをつくると,数がスッキリして扱いやすくなるわけです.
--
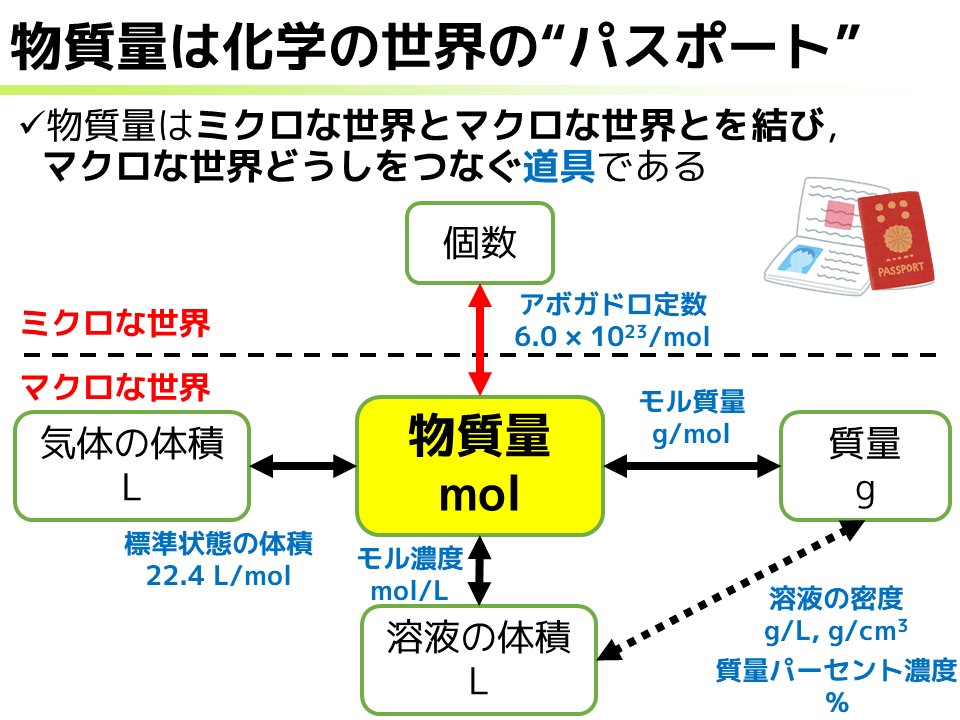
そんな物質量を,私は「化学の世界の”パスポート”」*21だと考えています.つまり,物質量を手に入れれば化学の世界どこにだって飛んでいけるわけです.
いまここに,「物質量はミクロな世界とマクロな世界とを結び,マクロな世界同士をつなぐ道具である」と書きました.これだけではよく分からないので解説しましょう.化学の世界は,原子や分子などが1つ,2つというとても小さな世界,ミクロな世界です.一方で,私たちの目に見えるサイズ感の世界(例えば気体の体積や質量など)は,そんな原子や分子などが大量に集まった世界,つまりマクロな世界です.でも,この2つの世界は視点が違うだけで,全く別のものではない.そこをつないでくれる立役者こそが物質量であり,ミクロな世界の個数とマクロな世界の物質量は,アボガドロ定数6.0×10^23 /mol*22によって繋げられ,自由に行き来することができるわけです.
もう1つ,例えば気体の体積や質量といったマクロな世界は,どちらも物質のある側面を取り出して見ているのであり,全く無関係なものではありません.したがって,これらの間にも何らかのつながりがあると考えるのが自然です.そこをつないでくれる立役者がこれまた物質量であり,気体の体積と物質量は標準状態の気体の体積22.4 L/molでつながり,物質量と質量はモル質量 g/molでつながっています.つまり,物質量を手にすることでマクロな世界の間を自由自在に飛び回ることができる,あたかも物質量は”パスポート”のようなものなのです.*23
--

で,ここまではこれまでの授業の復習で,ここからが今日の授業のメインディッシュである,「化学反応を表す言葉である化学反応式と,化学を定量的に考える道具である物質量の融合」になります.とても重要な部分なのできちんと押さえましょう.
毎度おなじみメタンの完全燃焼の化学反応式を考えましょう*24.この化学反応式を日本語*25に直すと,「1分子のメタンと2分子の酸素が反応して,1分子の二酸化炭素と2分子の水が生じる」*26となります.つまり,係数に着目することで「1分子のメタンから常に1分子の二酸化炭素が生じる」,言い換えると「メタン分子と二酸化炭素分子の個数の比は1:1」ということがいえます.
--

では,もう少し個数を増やして考えてみましょう.10分子のメタンからは何分子の二酸化炭素が生じるでしょうか? 100分子のメタンではどうでしょう? それじゃあ,一気に増やして6.0×10^23分子のメタンではどうでしょうか?*27そうですね,6.0×10^23分子のメタンからできる二酸化炭素分子は,個数の比が1:1ですから6.0×10^23個となります.
あれ,ちょっと待てよ.この数ってどこかで見たことがありません? そう,アボガドロ定数の数字部分ですね.アボガドロ定数の意味は「6.0×10^23個集まったものを1 molと定義する*28」ということなので,なーんだ,結局物質量の比も1:1になるじゃん,ということになります.
--

さて,ここで少し振り返ってみましょう.物質量の比である1:1はどこから来たかというと,個数の比から来ていますね.そして個数の比は化学反応式の係数の比から来ています.つまり,「化学反応式の係数がそのまま,物質量の比になっている」わけです.言い換えると,化学反応式の情報が手に入れば,物質量の比に関する情報も手に入るということになります.さらに言うと,先程の”パスポート”の話と絡めれば,化学反応式の情報が手に入れば質量や体積といった情報まで見えてくるわけです*29.
--

では,質量や体積と化学反応式の関係をもう少し見ていきましょう.毎度おなじみメタンの完全燃焼の化学反応式です.まず,化学反応式の係数の比がそのまま物質量の比になっているのでしたから,いま係数の比が1:2:1:2なので,例えば物質量をそれぞれ1 mol,2 mol,1 mol,2 molとでも置いてみましょう.いま各物質のモル質量を載せておきました.モル質量は「その物質が1 molあるときにどれくらいの質量になるか」を意味しているので,この値などを使えば各物質の質量や標準状態の気体の体積を求めることができますね.では,頭の体操がてら求めてみてください.
(計算中)
--

それでは確認していきましょう.まず質量についてはそれぞれ16 g,64 g,44 g,36 gとなりました.では,標準状態での気体の体積の方はどうでしょうか.~(中略)~では水の体積はどうなりました?
生徒\44.8 L/
…って言いたくなりますよね.いや,だってさっき「係数の比は物質量の比」って言ってたじゃん.だから2 molに22.4 L/molをかけてあげたんです.そう,その発想はとてもよく分かるし筋は良いのですが,これこそが「定量的のワナ」なんです.
ではみなさんに質問します.水は標準状態で気体ですか?
生徒「(ハッ…)気体じゃないですね」
そう,水は標準状態では液体です.なので,この問題に対する答えは「気体じゃないので定義できない」となります.*30
一度数字で表してしまうと,それをうにうに計算していくだけで色々な値が出てきます.ただ大事なのは,「その数字にどのような意味があるかを常に意識すること」です.例えば,体積を求めてマイナスだったら「なにか変だ…」と思えないとマズいわけです.そして,このような”嗅覚”を敏感にするために必要なのは,授業の最初に出した言葉で言うところの「定性的」な視点です.標準状態の水の様子を掴んでいれば,掛け算をやる前におかしいと気付けるわけです.みなさんはいま,化学を「定量的」に扱うための道具を手に入れましたが,これを常に「定性的」な視点で監視してあげることが大切になってきます.*31
--
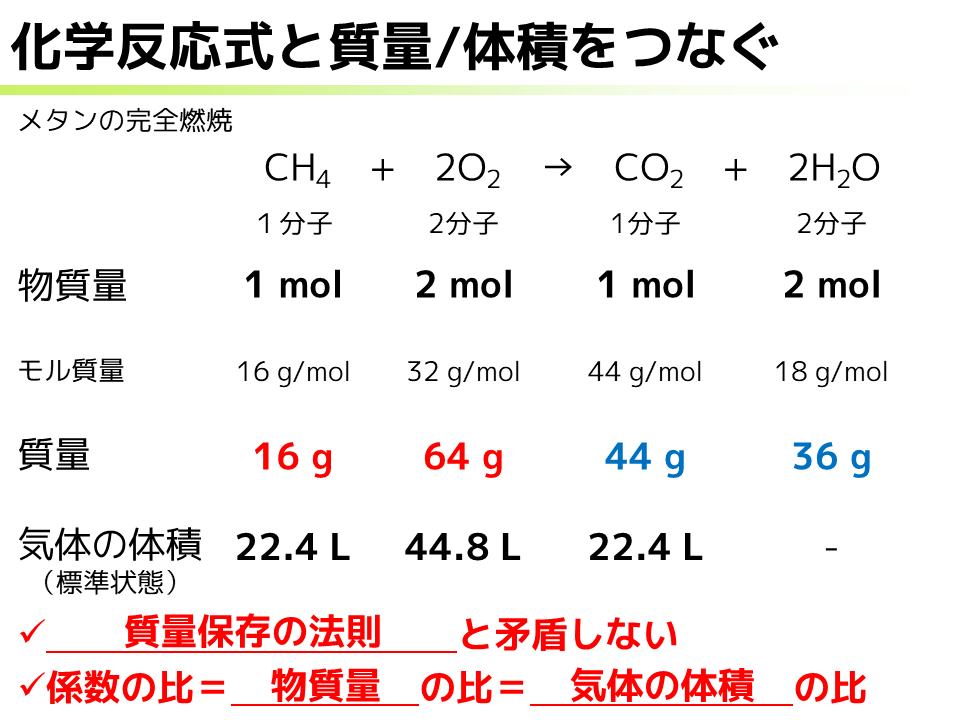
改めて,生成した水の標準状態での気体の体積は,「気体じゃないので定義できない」となります.ではここで,得られた数字をもう少し見ていきましょう.まず質量について,赤く示した反応物の質量と,青く示した生成物の質量をそれぞれ足してみてください.どちらも80 gとなって等しくなったかと思います.反応物と生成物の質量が等しい,つまり,反応の前後で質量が変化しない,質量保存の法則と矛盾しない結果が得られたということになります.まあ,質量保存の法則が発見されて,原子説が提唱されて,これに基づいて化学反応式を書いているわけなので,反応前後で質量が変わっていたらおかしいわけです*32.また,気体の体積の比を見てみると,22.4:44.8:22.4,つまり1:2:1ですね.物質量の比,1:2:1,係数の比,1:2:1,つまり係数の比は物質量の比であり,さらに気体の体積の比でもあるということになります.
--
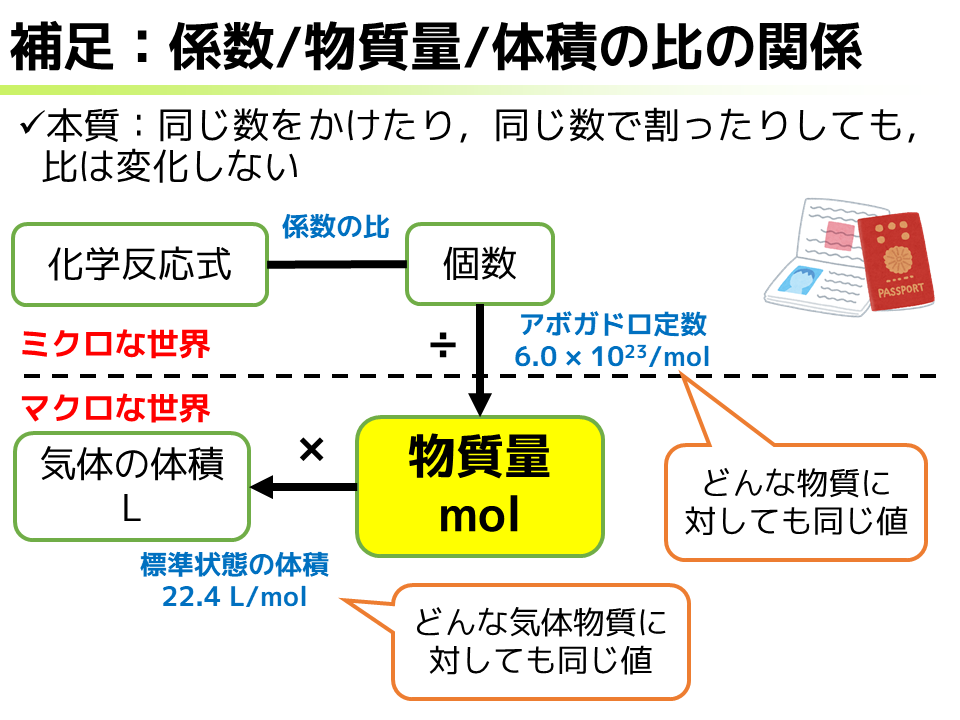
ここで少しだけ補足しておきましょう.今言った係数と物質量と気体の体積の関係は,よくよく考えたらそりゃそうだよねってなります.これらの本質は,「同じ数をかけたり,同じ数で割ったりしても比は変化しない」ことにまとまります.どういうことか.化学反応式の係数の比が個数の比になっていることは問題ないでしょう.次に個数から物質量に変換するためには,アボガドロ定数で割ってあげればいいですね.で,このアボガドロ定数,二酸化炭素分子だろうが水分子だろうが,どんな物質に対しても常に同じ値です.同じ値で割るんだから,比は変わるわけないですね.10:20と2:4と1:2とで比が変わらないのと同じです.そして物質量から標準状態の気体の体積に変換するためには,22.4 L/molをかけてあげればいいですね.これも,気体物質であるならばメタン分子だろうが二酸化炭素分子だろうが酸素分子だろうが,どんな物質に対しても同じ値になります.同じ値をかけるんだから,比は変わらないですね.1:2でも200:400でも5万:10万でも比が変わらないのと同じことです.*33
--

それではここからは,実際に様々な化学反応を定量的に考えていきましょう.とその前に.定量的に考える上では計算が欠かせません.でも,みなさんの中には計算問題がよく分からないと感じたり,なんとなく苦手意識をもっていたりする人もいるのではないでしょうか.そこでまずは,化学*34の計算を考える上で押さえておきたい視点を紹介します.それは,「何についてのどんな量」であるかを常に意識することです.言い換えるならば,「対象」と「単位」を逐一確認しながら進んでいくことが大切になります.この考え方は,私が高校生だった頃に自分で生み出したものなのですが,この考え方をするようになってから計算ミスや立式できない状況が一気に減りました.もちろんみんながみんなこの方法で上手くいくという保証はできませんが,もし計算に苦手意識がある人は参考にしてみるといいかもしれません*35.
「対象」というのはつまり,「いまあなたが見ているものは,メタン分子ですか,水分子ですか,はたまた水分子中の水素原子ですか?」といったものになります.これら対象を変換する,つまり見ているものを例えばメタン分子から水分子に変えるときには,さっきやりました「化学反応式の係数の比が物質量の比に等しい」というところから進めそうですね.メタン分子の”パスポート”を手に入れて,係数の比をもとにそれを水分子の”パスポート”に変えてあげればOKです.
「単位」というのは,「いまあなたが見ているものは,質量ですか,物質量ですか,はたまたモル濃度ですか?」といったものです.これはさきほど見せた”パスポート”の図を見れば分かるとおり,異なる量の間をつないでいる定数を噛ませてあげればOKです.
それでは,エタノールの完全燃焼を題材にして,実際に計算を行っていきましょう*36.大切なのは,解き方を丸暗記することではなく「頭の働かせ方を体得すること」です*37.”パスポート”を中心に置いて,「対象」と「単位」を1つ1つ追っていく「頭の働かせ方」が分かってしまえば,どのような状況でも対応することができますよ.
基本的な「頭の働かせ方」は,ここに書いた①~④のとおりです*38.まずはとにかく①化学反応式.化学反応を表す「ことば」がなかったら何も始められません.次に,②与えられている物質の物質量,”パスポート”を手に入れにいきましょう.これは「単位」の変換でたどり着けますね.そしたら,①で書いた化学反応式の係数をもとに,③係数の比から全物質の物質量を出してしまいましょう.これは「対象」の変換ですね.最後に,④求まった物質量を欲しい情報に「単位」の変換をしていけば完成です.もう一度整理すると,まず化学反応式,次に「単位」の変換で物質量にたどり着いてから,物質量を用いて「対象」の変換を行い,最後にまた「単位」の変換を行うという流れが基本の考え方になります.それでは実際に順番に見ていきましょう.
--

問題は,「4.6 gのエタノールを完全燃焼させたときに生じる二酸化炭素と酸素の質量,および完全燃焼に必要な酸素の標準状態での体積を求めよ」といったものです.まずは①とにかく化学反応式を手に入れることです*39.次に,②与えられている物質の”パスポート”を手に入れに行きます.今回与えられているのは「エタノール」の「質量」ですから,まず欲しいものは「エタノール」の「物質量」です.質量から物質量に単位を変換する際に必要な定数は,前のスライドを確認するとエタノールのモル質量ですね.
で,ここでかけるか割るかこんがらがってしまうことがあるかもしれません.そこで,計算をする上で有効な「単位の約分」の考え方を紹介しましょう.今回,スタートは質量 [g(エタノール)] *40,ゴールは物質量 [mol(エタノール)] になっていて,その間をモル質量 [g/mol(エタノール)] で変換することになります.いま [g] を [g/mol] で割ってあげると,形として [g] が約分されて [mol] が生き残ります*41.そして生き残った [mol] がゴールになっているので,結論としては「質量をモル質量で割れば物質量になる」ということになります.当然ですが,エタノールの質量を例えば酸素分子のモル質量で割っても意味のある数字は出てきません.常に同じ対象を見て処理することが大切です.
いまエタノールの物質量が0.10 [mol] と求まったので,次にやるのは③係数の比から全物質の物質量を出すことです.例えば酸素分子の物質量を求めてみましょう.エタノールの係数が1で酸素分子の係数が3なので,酸素分子はエタノールの3倍の0.30 [mol] と暗算で求まってしまいますが,「対象」を丁寧に追うためにあえて計算式を書いてみます.
0.10 [mol(エタノール)] × 3 [(酸素)] ÷ 1 [(エタノール)]
ここで,さっき単位を約分したのと同じ要領で,この式において機械的に(エタノール)を約分してしまう*42ことを考えると,残った単位は [mol] のままでその対象は酸素分子に変わるので,計算式上で酸素分子の物質量を出すこともできるわけです.生成物に関しても同じように計算するとそれぞれ値が出てきます.
これでみなさんは,今回登場する物質全てに関して”パスポート”を手に入れたわけです.そしたらあとは,④”パスポート”を欲しい情報に変換してあげれば完成ですね.例えば二酸化炭素分子の質量が欲しかったら,物質量と質量をつなぐ定数であるモル質量を物質量にかけてあげれば,[mol] が約分されて質量 [g] が出てきます.必要な酸素分子の標準状態での体積は,物質量に22.4 [L/mol(酸素)] をかけてあげれば求まります.なお,今回は22.4 [L/mol(酸素)] と書きましたが,どんな気体物質も標準状態での体積は22.4 [L/mol] で変わらないので,カッコの中はどんな気体分子を入れても大丈夫です.ただし,物質量の方に書かれている対象と同じものでないといけないことは押さえておきましょう.
--

ここまでで,計算する上での基本的な「頭の働かせ方」は完成です.では,次は練習問題を用いて「頭の働かせ方」を確認していきましょう.今回扱うのは過酸化水素水の分解反応です.基本的なプロセスはさっきの問題と変わりませんが,最初に与えられている情報が質量から溶液の質量パーセント濃度と溶液の質量に変わっています.したがって,質量パーセント濃度の定義にしたがって,溶質の質量の情報を手に入れに行くプロセスが加わります*43.質量パーセント濃度の定義は,溶質の質量を溶液の質量で割って100をかけた値になります.いま分かっているのは質量パーセント濃度と溶液の質量なので,この定義に代入することで溶質の質量を求めることができますね*44.これ以外は,さっきの問題と同じプロセスで,同じ「頭の働かせ方」で進むことができるでしょう.それではやってみてください.
(計算中)
--

では「頭の働かせ方」を見ていきましょう.まずやらなきゃいけないことは,とにかく化学反応式を手に入れることです.今回は酸化マンガン(IV)などの物質が出てきていますが,これは触媒なので反応式中には登場しないというのは,前回の授業で扱いました.また,「気体が発生する場合は上向き矢印を付けてもいい*45」というルールがあるので,一応今回も生成物の酸素分子に対して付けておきましょう.
次にやることは,与えられている情報から物質量の情報を手に入れることです.今回分かっているのは,過酸化水素水の質量とその質量パーセント濃度です.ここで,質量パーセント濃度の定義に基づいて値を代入していくと,過酸化水素の質量が1.7 gと出てきます.質量が手に入ったら,質量と物質量をつなぐ定数であるモル質量を用いて,過酸化水素の物質量を手に入れることができます.
1つの物質について物質量が手に入ったら,化学反応式の係数をもとにすべての物質の物質量が手に入ります.こうして”パスポート”を完璧に揃えてしまえばあとは楽勝,今回必要なのは酸素分子の標準状態での体積なので,酸素分子の物質量に22.4 [L/mol] をかけてあげればOKということになります.今回は物質量にたどり着くまでにワンクッションありましたが,”パスポート”を経由するという基本的な「頭の働かせ方」はさっきの問題と同じであることが分かったかと思います.
--
さて,これでこの授業で扱う内容は終わったので,簡単に次回予告.ズバリ,今回やった反応は”キレイ”な反応であって,実際の化学反応はもう少し”汚い”反応,つまり何らかの反応物が余るということが起こります.過不足があるわけです.そういったものをどのように考えていけばいいのかについて扱うのが次回の授業になります.今日扱った内容,特に「係数の比=物質量の比」と「頭の働かせ方」は次回のベースになるので,しっかりと押さえておいてください.では!
--
注釈
*1:実際の授業ではこの後に,前時に生徒からもらったコメントシートへの回答を行った.コメントシートは紙ベースで配布し,授業で分かりやすかった点・分かりにくかった点・質問・授業内容の要約などを自由に記述してもらった.授業改善に活かしたり,質問に答えることで生徒の理解を深めたりするのはもちろんのこと,生徒の要約から授業の改善点が見えてきたり,イラストや私の似顔絵などを添えてきたり(これは紙ベースの利点である)など,生徒との時間非同期なコミュニケーションを取ることができる有効なツールであると考える.
*2:これは私が最近言語学に興味を持っていることから取り入れた表現である.実際,化学反応式は化学を学んだ全世界の人と化学反応に関してコミュニケーションを取るための道具であるため,このような比喩を用いて説明することは妥当であると考える.
*3:前時のこの部分では,「化学反応式はあくまでも現象を表現したものであるため,実験結果と異なる化学反応式は間違いである」という説明を行った.化学反応式とその係数付けの方法を学ぶと,化学反応式をあたかもパズルのように”解く”ものと捉えてしまいかねない.しかしながら,化学反応式はあくまでも現象を書き表すための言葉であるため,現象が常に先行するということを強調するように心がけた.そういう意味でも,化学の指導においてできるだけ多くの化学反応に触れてもらうようにすることは重要であると考える.
*4:パイライトの完全燃焼を題材に,各原子の個数について連立方程式を立てるという程度の解説にとどめている.なお,パイライトに関しては実物を生徒に見せ,物質に対して親しみを持ってもらうことを狙った.
*5:イオン反応式は化学反応式の特別な場合である.
*6:『「理科の見方・考え方を働かせ」とあるのは,「自然の事物・現象を,質的・量的な関係や時間的・空間的な関係などの科学的な視点で捉え,比較したり,関係付けたりするなどの科学的に探究する方法を用いて考える」という「理科の見方・考え方」を働かせることを示している。』(【理科編 理数編】高等学校学習指導要領(平成30年告示)解説 p.83)
*7:化学史を扱うことは,現代化学の成果を大衆的・第三者的に捉えるのではなく,多大な努力の結晶として享受されているものであるという認識を持ってもらう上で極めて重要であると考えている.加えて,歴史はそれ自体が物語であり,歴史の文脈に乗せることで物事のつながりが際立ってくると考えている(宝槻泰伸『探究学舎のスゴイ授業 元素編』(方丈社)のエッセンスを参考にした部分である).授業全体を通して歴史の物語を紡ごうと試みたものの,私の文献調査力不足もあって,人物&業績紹介にとどまってしまったところは今後の課題である.
*8:山岡望「化学史傅」(内田老鶴圃)では,近代化学の立役者10人にスポットを当てて化学の体系・法則などを整理しているが,その最初に登場するのがロバート・ボイルである.
*9:なお,教科書上ボイルの法則は気体の状態方程式の下位互換のように記載されていて,実際科学の発展の歴史として正しいのだが,化学史を踏まえるとボイルの法則の偉大さはもう少し強調されてもいいのではないかと考えている.
*10:詳細は基礎がついていない化学の方で扱うため,ここでは「来年以降にきちんと学ぶ」ことを付記した上で厳密性をある程度犠牲に大枠のみを述べている.参考までに私のスタンスを紹介すると,「後により正確に学ぶことをリファーする条件で,説明やその受け取られ方が大枠としてズレていないのであれば(=翻訳として妥当であれば),細部の厳密性に過度にこだわる必要はない」である.
*11:このあたりの化学史の話は,先述の「化学史傅」の他にも廣田襄「現代化学史」(京都大学学術出版会),アイザック・アシモフ「化学の歴史」(ちくま学芸文庫),三宅泰雄「空気の発見」(角川ソフィア文庫)あたりが参考になる.
*12:定義を出発点にして考える姿勢も伝えている.
*13:このあたりは,私が科学コミュニケーション上がりの人間であることが色濃く出ているように思える.しかしながら,化学を化学で閉じずに他の分野と有機的につなぎながら情報を豊かにしていくことは,教育心理学で扱う精緻化の観点からも有効な手段であると考えている(藤田哲也編著「絶対役立つ教育心理学」(ミネルヴァ書房)).なお,この「つなぐ」というところがカギであり,ここでも雑多に情報を増やしただけではないという点は強調しておきたい.
*14:文を追っていく途中には,語源の話をいくらか組み込んだ.例えば,"atom"は"a-(否定の接頭辞)"+"tom(←分ける)"から来ていたり,"molecule"は"mole(塊)"+"-cure(「小さな」を表す接尾辞)"から来ていたりといった内容である.
*15:クラスターというと金属ナノ粒子がメジャーだが,フラーレンのような共有結合クラスターも存在する.ここでは,物質量の定義から派生して物質観を涵養しつつ,以前学習した同素体の復習を行うことも意図している.
*16:化学は英語で考えると意外とクリアに見えてくることがある.例えば,質量作用の法則は"Law of mass action"=集団のふるまいに関する法則であり,酸化は"be oxidized by"のように受動態をとる.
*17:これは私が翻訳について学ぶ中で考えついたアイデアである(山本史郎「翻訳の授業」(朝日新書),伊藤亜紗・林阿希子・渡邊淳司「見えないスポーツ図鑑」(晶文社)など).よく比喩を用いた説明において「分かりやすさと正確性はトレードオフ」などと言われることがあるが,比喩を用いた説明で大切なのは元の概念と相似な構造を持つ身近なものを取り上げることであり,その相似性が十分に大きかったら分かりやすさと正確性のトレードオフを抑えることができると考えている.ここでは続けて説明されるように,「玉と札の関係」と「個とmolの関係」の相似性に着目している.この説明は多くの方から好評を得ており,相似性が十分に高いものであると考えられるため,ぜひ活用していただきたい.
*18:「通貨の単位及び貨幣の発行等に関する法律」第7条による.
*19:物質量は大量のものをひとまとめにして捉えるものである以上,物質量で考えた時点でそこに1つ1つの粒子は見えなくなるが,必要に応じていつでも個数に直すことができる.これはまさに,1万円札を見て1円玉を思い浮かべることはないが,必要なら(必要はほとんどなさそうだが…)いつでも両替することができる構造と相似である.表面に出てこない本質的・構造的な部分に目を向け,そこを詳細に検討する視点こそ,私が翻訳に触れることを通じて得たものである.
*20:例えば1円玉1枚を構成する原子の数は,およそ200垓個である.私が以前行ったサイエンスショーで小学生に聞いてみたところ,高々億レベルという認識を持っているため,物質量を扱う際にはサイズに対する素朴概念を大きく上回るだけの個数のものを考えているという点に留意する必要があるだろう.
*21:これもある種の翻訳である.
*22:実際は復習も兼ねて,異なる対象をつなぐ定数は生徒に問いかけながら進めていった.
*23:生徒の中には,物理量間の変換を個別に覚えることに目が向いてしまうことが少なくないが,「物質を様々な側面から眺めるための,物質量を中心としたネットワーク構造」が見えるようになり,「種々の定数は物質の側面間をつなぐ道具」であると理解することで,物質の扱いや理解が深まるのではないかと考えている.
*24:前時「化学反応式」でもメタンの完全燃焼を扱ったがゆえの表現である.
*25:前回の授業で,化学反応を捉える言葉を「日常の言葉」「化学の日本語」「化学反応式」の3つの段階に区分して説明している.「日常の言葉」とは,例えば炭酸水素ナトリウムの熱分解では「重曹を加熱すると泡が出て白く曇った」のように,日常生活で使われている用語を用いて現象を記述するものである.一方で「化学の日本語」は,化学は物質を扱う学問であることに基づき,「炭酸水素ナトリウムを加熱すると二酸化炭素と水が生じた」のように物質ベースで現象を捉えることを意味している.これをさらに記号化したものが「化学反応式」である.このような説明は,日常言語と化学言語の間の橋渡しをしつつ,「化学は物質とその変化を扱う学問」「化学反応式は物質に着目した化学反応の記号化」という2つの重要な視点の理解を意図している.
*26:表現として以下の論文を参考にした.佐々木克巳 化学式および化学反応式の取り扱い上の諸課題 化学教育 1963, 11, 475.
*27:ミクロとマクロの間の行き来に必ずしも慣れていない生徒を考慮して,その間を埋める発問を入れるように心がけた.
*28:多くの定数は単位量あたりの量であるが,これを理解するのは生徒にとってなお容易ではないだろう.そこで,単位量あたりの量に関しては可能な限り日本語に翻訳して伝えることが大切であると考えている.
*29:振り返りによる思考過程の再確認・整理や,要約による本質抽出,同値表現による本質情報の上塗り,既習事項との関連付けによる理解深化など,本当に大切なところは様々な形で繰り返すことが肝要だろう.このことは,私が滝川洋二先生の理科教育法の講義を受けた際に徹底的に叩き込まれ,その経験が今の私のやり方を形作っている.
*30:ここでは,一度あえて”騙す”ことで理解の増進を図っている(ほとんどの生徒が”騙される”ことは狙い通りである).騙されないためのアンテナを張るにあたっては,一度騙されることが最も有効なトリガーではないだろうか.
*31:東進ハイスクール講師の苑田尚之先生の名言に「数式は言葉です,計算じゃない.」というものがあるが,「数式は計算」と捉えてしまう生徒が一定数いる以上,式の意味,式が表す言葉に踏み込む視点は提供するに値するだろう.
*32:ともすると,「質量保存の法則が成り立っていることを確認できる」と表現してしまいかねないが,これは因果関係が逆転してしまっているため適切な表現とはいえない.かつ,これでは「化学反応式スゲー!」という誤った感動や過剰な崇拝を生みかねない.あくまでも,化学反応式は質量保存の法則の上に積み上がったものであるため,「化学反応式の導入によって既存の理論体系に矛盾が生じない」というスタンス,言い換えれば既存の理論体系を主体に置く姿勢は欠かせないのではないかと考えている.ついでに述べると,仮説を断定表現すること,例えば原子説を「反応前後で原子の個数は変化しない」のように言い切ってしまうこともふさわしくないのではないかと考えている.一定の確からしさを有しており,特に原子説に至っては検証に耐えた相当確かなものであるだろう.とはいえあくまでも仮説であるため,それが正しいとは(科学の世界にいる限り)永遠に言い切ることができない.「~変化しないものと考えましょう.」のように,絶対的なものであるかのように伝えないことも大切ではないかと考えている.
*33:このスライドは,情報のつながりを意識することや,科学/化学の本質を貫く汎用性の高い情報を伝えることを意図して組み込んだ(松田聡平「名人の授業シリーズ 松田の数学Ⅰ・A/Ⅱ・B 典型問題Type100」(ナガセ)のエッセンスを取り入れたつもりであるが,まだまだ力不足で至らない部分が大いにあるだろう.).学習においては,情報をつなぐことでネットワークを細かくしていくと同時に,情報を編集することで”情報密度”なるものを高めることも大切であると考えている.
*34:科学と捉えることもできる.化学と科学の同音異義語の関係性は,混乱を招くこともあるがうまく活用することもできる.
*35:ただ,この後の問題演習の様子からは,従来の自分のやり方で解こうとして苦しんでいる生徒が一定数見られた.より伝わりやすい方法がないか検討することが今後の課題である.
*36:本時で扱うのは,過不足が生じない”キレイ”な反応である.本来着目すべきなのは反応前後の物質量の変化分Δnであるが,変化分に着目することは次時「過不足が生じる際の量的関係」のメインテーマとして取っておくこととし,本時ではそこまで扱わないことにした.
*37:私の中では「覚えるんじゃなくて覚えちゃうくらい習熟せよ」というスローガンを持っている.そして,その「覚えちゃう」ための足場づくり・骨組みの構築を志向した射程の長い学びこそが,私の授業の主眼である.次のスライドに登場するように,対象の変換と単位の変換をそれぞれ横向き矢印(横の移動)と縦向き矢印(縦の移動)に整理して提示していることも,足場づくり・骨組みの構築の一例といえよう.
*38:まさに「足場づくり・骨組み」である.情報を整理・処理する視点となる基本フレームを明確に示すことで,汎用性の高い形で化学の考え方を伝えることができると考えている.解法を一対一対応で覚えさせようとしているものではない点に注意していただきたい.
*39:実際は前時の復習を行いながらある程度丁寧に追っていったが,ここでは省略する.
*40:カッコ内は対象を指している.この表記が後の説明を行う上でも活きてくる.
*41:言葉だとやや分かりにくいかもしれないが,板書では分かりやすく図解で示している.
*42:イオンや電子などの要因が絡んでくると,自分がいま見ている対象を見失ってしまうことがあるだけでなく,暗算で処理することも徐々に難しくなってくる.そこで,計算式上に対象を常に明記しながら追っていくようにすることで,自分がいま見ている対象を明確にし,状況をきちんと整理できるようになるのではないかと考えてこの表記を取り入れた.
*43:「定義はきちんと覚えること」と「概念や頭の働かせ方は理解すること」は,セットできちんと伝える必要があると考えている.定義は議論の出発点であるため,ここが分かっていないとその後の話を咀嚼することは困難になる.一方で,すべてを覚えるのは負担の割に汎用性がそこまで高くならないため,化学のキモとなる部分は概念形成を図るのが有効だろう.何を覚えて何を理解すればいいのかを初学者である生徒自身で見出すことが難しい以上,この部分を明確に整理して伝えることが教える側に立つ人の責務であるという意識を持って授業を設計した.
*44:当初はこの部分を演習後に説明していたが,生徒が濃度の概念を押さえることに困難を示していたため,先に提示する方針に変更した.単位量あたりの量の概念を掴むのは中々に大変であり,だからこそ様々な形で反復して概念を掴むことが重要となる.
*45:これはマストではない.化学反応式は化学反応を表現することばであるという立場に立つと,この上向き矢印は修飾語のようなものである.